“亞培”復邁針筒裝注射劑
Humira 40mg Solution for Injection, Pre-filled Syringe
衛署菌疫輸字第000776號
“亞培”復邁注射劑
Humira 40mg Solution for Injection, Vial
衛署菌疫輸字第000775號
本藥限由醫師使用
產品名
Adalimumab注射溶液
含有adalimumab注射溶液的預充填式注射器
商品名
Humira
說明
Humira是一種基因重組人類免疫球蛋白(IgG1)單株抗體,只含有人類胜肽序列。Humira是以噬菌體呈現技術 (phage display technology)得到人類重鏈和輕鏈差異區序列,具有對人類腫瘤壞死因子(TNF)和人類IgG1重鏈和kappa輕鏈序列的專一性。Humira對可溶性腫瘤壞死因子(TNF-alpha)有高度的親和性和專一性,但對淋巴毒素(TNF-beta)並無此特性。Adalimumab是藉由哺乳動物細胞表現系統的基因重組技術而製造,含有1330個胺基酸,分子量約為148 kilodalton。
Humira是以無菌、不含防腐劑的非經腸胃道的注射溶液供應。Humira的溶液清澈、無色,其pH值為5.2。每一單一劑量預充填式注射器或小瓶中,含有40 mg的adalimumab 於0.8ml溶液(50 mg/mL)。
非活性的成份包含:4.93 mg sodium chloride、0.69 mg monobasic sodium phosphate dihydrate、 1.22 mg dibasic sodium phosphate dihydrate、 0.24 mg sodium citrate、1.04 mg citric acid monohydrate、 9.6 mg mannitol、0.8 mg polysorbate 80 和注射用水。
臨床藥理學
一般
Adalimumab對TNF有專一的結合性,並可藉由阻斷其與p55和p75細胞表面TNF接受器的交互作用而中和TNF的生物活性。TNF是一種與正常發炎和免疫反應有關的天然生成細胞素 (cytokine)。TNF的濃度升高可於類風濕性關節炎病患的關節液發現,這對病理性炎症和關節破壞扮演著重要的角色,也是類風濕性關節炎的顯著特徵。
Adalimumab也調節由TNF誘發或控制的生物反應,包括負責白血球細胞遷移的黏著分子濃度變化(ELAM-1、VCAM-1和 ICAM-1,50%抑制濃度(IC50)為1-2 X 10 -10 M)。
藥物藥效學
在接受Humira治療後,可發現炎症急性期反應物(C反應蛋白(CRP)和紅血球沉降率(ESR))和血清細胞激素(IL-6)的濃度較類風濕性關節炎病患的基準值快速降低。產生組織再造而造成軟骨破壞的細胞基質蛋白酵素(Matrix metalloproteinases, MMP-1和MMP-3)的血清濃度也在投與Humira後降低。類風濕性關節炎的病患常發生輕度至中度的貧血和淋巴細胞數的降低,並且會有嗜中性白血球和血小板數量的升高。接受Humira治療的病患通常在慢性炎症的這些血液指標上得到改善。
以美國風濕病學院的反應標準(ACR 20)測量血清adalimumab的濃度-療效關係,顯示遵照Hill Emax公式如下:
圖一:濃度-療效關係
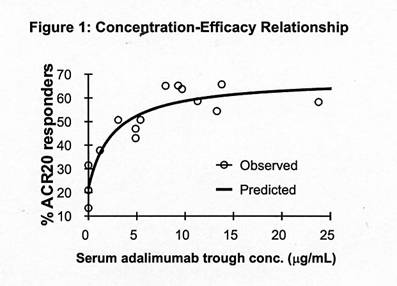
經由藥物動力學/藥物藥效學模式分析第二和第三階段試驗病患的浮腫關節數量、觸痛關節數量和ACR 20的反應得到半數有效濃度(EC50) 預估值介於0.8至1.4 mcg/mL之間。
藥物動力學
吸收
在皮下投與單一劑量40 mg的Humira 至59位健康受試者後,adalimumab的吸收和分佈緩慢,平均最高血清濃度在投藥後5天到達。在三項研究中,皮下投與單一劑量40 mg的adalimumab後,其平均絕對生體可用率預估為64%。
分佈和排除
單一劑量adalimumab的藥物動力學在幾個研究中投與0.25至10 mg/kg的靜脈劑量後測定。Adalimumab的分布體積(Vss)介於4.7至6.0 L,表示adalimumab大約平均分布於血管和血管外液之間。Adalimumab的排除緩慢,清除率通常小於12 mL/h。這幾個研究的平均最終半衰期約為2週,範圍介於10至20天。在所研究的劑量範圍,清除率和半衰期並不因研究劑量而相對改變,且靜脈和皮下投藥後的最終半衰期相似。一些類風濕性關節炎病患關節液中的adalimumab濃度,為adalimumab在血清中濃度的31至96%。
穩定狀態的藥物動力學
在每隔一週皮下投與40 mg的Humira至類風濕性關節炎的病患,平均穩定狀態最低濃度(trough concentration)約為 5 mcg/mL (無併用methotrexate(MTX))和8至9 mcg/mL(併用MTX),可以利用半衰期預測adalimumab的蓄積情況。在以20、40、80 mg每隔一週和每週皮下投藥後,在穩定狀態下的血清adalimumab最低濃度(trough level)約隨劑量成比例增加。在投藥超過2年以上的長期研究中,並無證據顯示清除率會隨著時間而改變。
包括超過1200位病患資料的族群藥物動力學 (population pharmacokinetic)
分析顯示,與MTX併用對adalimumab的表觀清除率(apparent clearance, CL/F)(見”臨床藥理學-藥品交互作用”)有內在的影響。如預期地,隨著體重的增加和抗adalimumab抗體的存在,adalimumab的表觀清除率有升高的傾向。
其他較次要的因素也被確認:接受低於建議劑量的病患和類風濕性因子或C反應蛋白(CRP)濃度高的病患,預測會有較高的表觀清除率,這些因素不太可能具有 臨床上的重要性。
特殊族群
特殊族群的藥物動力學是利用族群藥物動力學分析研究。
老年人
年齡似乎對adalimumab的表觀清除率有極小的影響。在族群分析中,40歲至65歲(n=850)和大於或等於65歲 (n=287) 病患調整體重後的平均清除率分別為0.33和0.30 mL/h/kg。
兒童
尚未在兒童病患進行Humira的研究。
性別
在調整病患的體重後,並無性別相關的藥物動力學差別。
種族
免疫球蛋白清除率預期不會因種族而有差別。從有限的非白種人資料並無發現adalimumab動力學的重大差別。
肝和腎功能不全
並無肝和腎功能不全病患的藥物動力學資料。
疾病狀態
健康受試者和類風濕性關節炎的病患顯示相似的adalimumab藥物動力學。
藥物交互作用-Methotrexate
當投與Humira至21位穩定接受MTX治療的病患時,血清中MTX濃度的改變並沒有統計上的意義。相對地,在單一和多次投藥後,MTX分別使adalimumab的表觀清除率降低29%和44%(見”注意事項-藥品交互作用”)。
臨床試驗
臨床試驗說明
Humira在所有的臨床試驗中有超過2330位的病患中受到評估。有些病患接受超過36個月的治療。Humira的療效性和安全性曾在4個隨機、雙盲和受到良好控制的試驗中評估。
試驗一評估271位大於或等於18歲正患有中度至重度類風濕性關節炎的病患,且曾以至少一種但不超過四種的疾病修飾抗風濕藥物(DMARD)(如hydroxychloroquine、 口服或可注射金製劑(gold)、azathioprine、D-penicillamine、 sulfasalazine)治療失敗,且曾每週以劑量12.5至25 mg的MTX (若是MTX不耐受則以10 mg的劑量),以及MTX的劑量持續維持在每週10至25 mg無法達到有效治療。病患曾有6個或6個以上的浮腫關節和9個或9個以上的觸痛關節,並且依據ACR標準診斷為類風濕性關節炎。每隔一週投與劑量為20、40或80 mg的Humira或安慰劑,為期24週。
試驗二評估544位大於或等於18歲正患有中度至重度類風濕性關節炎的病患,且曾以至少一種疾病修飾抗風濕藥物(DMARD)(如MTX、sulfasalazine、hydroxychloroquine、口服或可注射金製劑 、D-penicillamine azathioprine)治療失敗。病患曾有10個或10個以上的浮腫關節和12個或12個以上的觸痛關節,並且也依據ACR標準診斷。每隔一週以皮下注射投與劑量為20或40 mg的Humira,而於其他週或每週投與安慰劑,為期26週;安慰劑於相同的期間每週投與。
試驗三評估619位大於或等於18歲正患有中度至重度類風濕性關節炎,且曾每週以劑量12.5至25 mg的MTX無法達到有效治療 (若是MTX不耐受則以10 mg的劑量), 以及MTX的劑量持續維持在每週12.5至25 mg,而無法達到有效治療的病患。不同於試驗一,試驗三的病患不需曾經有任何一種疾病修飾抗風濕藥物 (DMARDs) 的治療失敗,但MTX除外。病患曾有6個或6個以上的浮腫關節和9個或9個以上的觸痛關節,並且依據ACR標準診斷為類風濕性關節炎。本試驗共有三組。第一組接受每週的安慰劑注射為期52週。第二組每週接受20 mg的Humira,為期52週。第三組每隔一週接受40 mg的Humira,而於其他週接受安慰劑注射。此試驗並持續額外一年開放性的期間。
試驗四評估636位大於或等於18歲正患有中度至重度類風濕性關節炎的病患。這些病患符合ACR標準診斷為類風濕性關節炎至少達3個月,並且曾有6個或6個以上的浮腫關節和9個或9個以上的觸痛關節。病患可以不曾接受疾病修飾抗風濕藥物(DMARD)的治療或持續其現有的類風濕性關節炎治療,只要治療已穩定持續至少28天。病患隨機分配至每隔一週40 mg的Humira或安慰劑,為期24週。
此四項試驗的結果全部以ACR的反應標準判斷類風濕性關節炎改善程度的病患百分比來表達。試驗一、二和三的主要療效指標和試驗四的次要療效指標為於第24或26週達到ACR 20反應的病患百分比。試驗三有其他的主要療效指標為於第52週疾病惡化的遲緩(以x光檢測)和生活品質的改變。
臨床反應
試驗一、二和三
在所有三項試驗中接受Humira治療且達到ACR 20、50和70反應的病患百分比一致。此三項試驗的結果總結於表一:
|
表一:安慰劑控制試驗中ACR反應 (病患百分比) |
||||||
|
反應 |
試驗一a* |
試驗二a* |
試驗三a* |
|||
|
|
安慰劑/ MTX n=60 |
Humira b/ MTX n=63 |
安慰劑 n=110 |
Humira b *n=113 |
安慰劑/ MTX n=200 |
Humira b / MTX n=207 |
|
ACR 20 6個月 12個月 |
13.3% NA |
65.1% NA |
19.1% NA |
46.0% NA |
29.5% 24.0% |
63.3% 58.9% |
|
ACR 50 6個月 12個月 |
6.7% NA |
52.4% NA |
8.2% NA |
22.1% NA |
9.5% 9.5% |
39.1% 41.5% |
|
ACR 70 6個月 12個月 |
3.3% NA |
23.8% NA |
1.8% NA |
12.4% NA |
2.5% 4.5% |
20.8% 23.2% |
a 試驗一於24週、試驗二於26週、試驗三於24週和52週
b 每隔一週投與40 mg的Humira
* p<0.01,在所有的時間點Humira相較於安慰劑的ACR 20、50、70
試驗二中每週接受40 mg Humira的病患,於第6個月時ACR 20、50和70的反應率分別達到具有統計意義的53.4%、35.0%和18.4%。
試驗三的ACR反應標準結果細項列於表二。下列敘述結果一般可代表每一個執行過的試驗。
|
表二:試驗三的ACR反應 |
||||||
|
變數值(中間值) |
安慰劑/MTX(n=200) |
Humira a /MTX(n=207) |
||||
|
基準值 |
24週 |
52週 |
基準值 |
24週 |
52週 |
|
|
|
26.0 |
15.0 |
15.0 |
24.0 |
8.0* |
6.0* |
|
浮腫關節的數量(0-66) |
17.0 |
11.0 |
11.0 |
18.0 |
5.0* |
4.0* |
|
醫師總體評估疾病活性b |
63.0 |
35.0 |
38.0 |
65.0 |
20.0* |
16.0* |
|
病患總體評估疾病活性b |
53.5 |
39.0 |
43.0 |
52.0 |
20.0* |
18.0* |
|
疼痛b |
59.5 |
38.0 |
46.0 |
58.0 |
21.0* |
19.0* |
|
殘障指數(HAQ) c |
1.50 |
1.25 |
1.25 |
1.50 |
0.75* |
0.75* |
|
CRP(mg/dL) |
10.0 |
9.0 |
9.0 |
10.0 |
4.0* |
4.0* |
a 每隔一週投與40 mg的Humira
b 視覺類比尺度;0 = 最佳,100 = 最差
c 健康評估問卷的殘障指標2;0 = 最佳,3 = 最差,評估病患實行下列活動的能力:穿衣/打扮、起立、吃飯、步行、伸手、緊握、保持衛生和維持日常活動
* p<0.001,Humira相較於安慰劑,以自基準值的平均改變值為依據
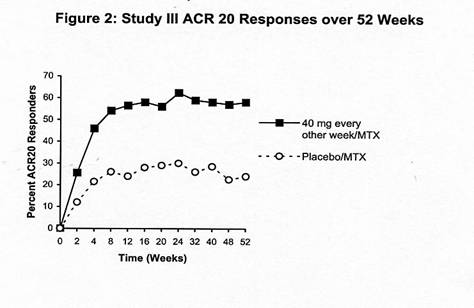
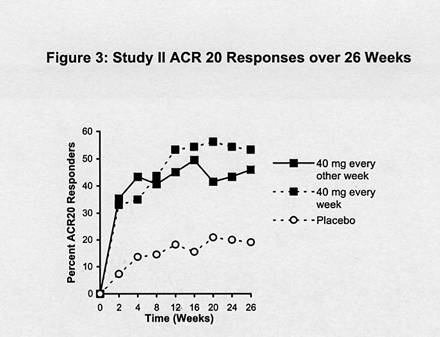
試驗三中, 84.7%在24週有ACR 20反應的病患在52週保持相同的反應。下列圖表說明在試驗三和二中對Humira ACR 20反應的耐久性。
圖二:試驗三52週間的ACR 20 反應
圖三:試驗二26週間的ACR 20 反應
試驗四
接受Humira治療和標準照護的病患的ACR 20反應相較於接受安慰劑治療和標準照護的病患具有統計意義的改善 (p<0.001)。並無觀察到Humira和其他DMARDs藥物併用相關的獨特不良反應。
在所有四個試驗中,接受Humira治療的病患比接受安慰劑治療的病患較快且較常達到ACR 20、50和70反應。在試驗一中,接受Humira治療的病患(26.5%)和接受安慰劑的病患(5.0%)在第一週 (第一次試驗回診) ACR 20反應差別具有統計意義。具有統計意義的ACR 20反應差別也見於試驗二、三和四的第二週(第一次試驗回診) 接受Humira治療的病患 (分別為36.4%、29.1%和33.7%) 和接受安慰劑的病患 (分別為7.3%、13.0%和8.6%) 之間。第一個ACR 50和70反應時間也於所有四項試驗中觀察到具有相似的型態。
有些沒有併用MTX的病患可能因為增加Humira的投藥頻率至每週40 mg而得到額外的益處。這可從一個開放性的長期試驗中得到確認,其中有不完全反應的病患從每隔一週40 mg增加投藥頻率至每週40 mg。
放射線照相反應
試驗三中,接受Humira治療的病患平均罹患類風濕性關節炎的期間約為11年,結構關節損害以放射線照相評估並以調整過的全部Sharp分數(modified total Sharp score)及其成分:侵蝕分數(erosion score)和關節空間狹隘分數(JSN)的改變來表達。手/手腕和前足的放射線照相於基準值、6個月和12個月讀取。第12個月的結果列於表三。調整過的全部Sharp分數和侵蝕分數在第6個月時可觀察到具有統計意義的改變,並且於第12個月時維持不變。
|
表三:試驗三中以MTX為比較於為期12個月間放射線照相的改變 |
||||
|
|
安慰劑 N=200 |
Humiraa N=207 |
Humiraa和安慰劑 的差別 |
p值 |
|
調整過的全部 Sharp分數的改變 (平均值) |
2.7 |
0.1 |
-2.6 |
≤0.001b |
|
侵蝕的改變 (平均值) |
1.6 |
0.0 |
-1.6 |
≤0.001 |
|
沒有新的 (病患的百分比) |
46.2 |
62.9 |
16.7 |
≤0.001 |
|
JSN分數的改變 (平均值) |
1.0 |
0.1 |
-0.9 |
0.002 |
|
a 每隔一週投與40 mg b 以中間值為根據 |
||||
生活品質
在所有四個適當且受到良好控制的試驗中,利用健康評估問卷(HAQ)的殘障指標來評估健康相關的生活品質,也是試驗三在第52週先前已確定的主要療效指標。在所有四個試驗中Humira所有劑量/時間表顯示,從基準值至第6個月時HAQ的殘障指標相較於安慰劑具統計上有意義的改善。試驗三中,從基準值至第52週每隔一週40 mg的劑量,Humira併用MTX的平均改善值為0.59 (0.51、0.66),相較於安慰劑併用MTX為0.25 (0.17、0.33)(p<0.001)。
在所有四個適當且受到良好控制的試驗中,簡式健康調查(SF 36)也用來評估整體與健康相關的生活品質。在所有四個試驗中,Humira所有的劑量/時間表顯示從基準點至第6個月SF 36身體細項總分數較安慰劑有統計意義的改善,這也在試驗三的第52週繼續保持。試驗二和四中,Humira在第6個月時SF 36心理細項總分數也較安慰劑有統計意義的增加。在所有四個試驗中,SF 36的疼痛和生命有關分數顯示從基準點至第6個月每隔一週劑量40 mg的Humira較安慰劑有統計意義的改善。這些發現可由慢性疾病治療功能性評估(FACIT)分數得到證實,顯示在所有分析的三個試驗中,第6個月時疲倦有統計意義的的減輕,並且在試驗三的第52週繼續保持。
免疫性
試驗一、二和三的病患在第6至第12個月的期間於數個不同的時間點測驗抗adalimumab抗體。5.5%成人風濕性關節炎病患在治療期間,至少有一次在血清中測出有adalimumab抗體血清。adalimumab抗體似乎對Humira的安全性並無影響。
由於免疫性的分析具有產品特定性,與其他產品比較抗體率並不合適。
適應症
Humira適用於患有中度至重度類風濕性關節炎並且曾經對一種或超過一種的DMARDs藥物有不適當反應的成人病患,可減輕症狀和抑制結構上損害的惡化。
Humira可單獨使用或與methotrexate或其他DMARDs藥物併用。
禁忌
Humira禁用於已知對Humira或Humira其他賦形劑過敏的病患。
警告
感染
嚴重感染和敗血症,包括死亡,曾於使用TNF的拮抗劑時發生。許多嚴重感染已發生於併用免疫抑制療法的病患,而使病患更易受到除了他們的類風濕性關節炎以外的感染。肺結核曾於接受包括Humira 之TNF拮抗劑的病患中發現。
除非感染已受到控制,否則Humira的治療不應用於感染發作期間的病患,包括慢性或局部感染。
如同其他TNF拮抗劑,病患應於Humira治療之前、治療期間和之後受到緊密的感染監測-包括肺結核。
於接受Humira治療時發生新感染的病患應受到緊密的監測。如果病患發生嚴重的新感染,則應停止投與Humira直到感染得到控制。醫師應小心考慮使用Humira於有復發性感染病史或有潛在病況而有可能較易受到感染的病患。
神經事件
TNF拮抗劑,包括Humira,在極少數病例中與去髓鞘疾病 (demyelinating disease) 的臨床症狀和/或有放射線證明的惡化有關。開處方者應小心考慮使用Humira於患有前置性或最近引發的中樞神經系統脫髓鞘疾病的病患。
注意事項
過敏
嚴重過敏不良反應未曾於臨床試驗中皮下投與Humira時報導過。與Humira有關的非嚴重過敏不良反應於臨床試驗中並不常見。若有嚴重過敏反應發生時,應立即停止投與Humira並開始適當的治療。
肺結核
如同在其他TNF抑制劑所觀察到的,與投與Humira有關的肺結核曾於臨床試驗中報導過。
雖然肺結核的病例曾於所有不同劑量觀察到,肺結核復發發生率的增加特別在Humira高於建議劑量時發生。所有的病患在標準抗微生物治療後痊癒。於臨床試驗中並無發生因肺結核而死亡的病例。
在開始Humira治療前,所有的病患應接受活性或非活性(潛伏性)肺結核感染的評估。此評估應包括病患先前可能受到活性肺結核的感染和先前和/或現有的免疫抑制治療的詳細病史。應遵照當地的建議執行適當的篩檢試驗 (如胸部x光或結核菌試驗)。
如果診斷患有活性肺結核,則不應開始Humira的治療。
如果診斷患有潛伏性肺結核,應於Humira的治療開始前依當地建議給予適當的抗肺結核預防。
應指導病患如有暗示肺結核感染的症狀 (如:持續咳嗽、虛弱/體重減輕、微熱) 發生時,尋求醫師建議。
免疫抑制
在一項有64位接受Humira治療的類風濕性關節炎病患的試驗中,並無證據顯示遲發性過敏反應的機能降低、免疫球蛋白濃度的降低或功能細胞T和B細胞和NK細胞、單核白血球細胞/巨噬細胞和嗜中性白血球數量的改變。
疫苗注射
61位以Humira和MTX治療的類風濕性關節炎病患,接受肺炎雙球菌疫苗。大部分接受Humira的病患可對肺炎雙球菌多醣疫苗產生有效的B細胞免疫反應。但由於並無相關資料,不建議Humira和活性疫苗併用。
藥物交互作用
曾於併用MTX的類風濕性關節炎病患研究Humira(見〝臨床藥理學〞) ,結果顯示不需要調整Humira或MTX的劑量。
尚未於正式藥物動力學試驗中評估Humira和MTX以外之藥物的交互作用。臨床試驗中,當Humira和常用的DMARDs藥物(sulfasalazine、hydrochloroquine、leflunomide和非經腸道的金製劑)、糖質類固醇、水楊酸、非類固醇類抗發炎藥物或止痛劑使用時,未曾觀察到交互作用。
藥物/實驗室試驗交互作用
無已知干擾存在於Humira和實驗室試驗之間。
臨床前安全資料
以單一劑量毒性、重複劑量毒性和基因毒性為根據的臨床前資料顯示,對人類無特別危險。
致癌性、突變性和生殖力的損害
未執行長期的adalimumab動物試驗以評估致癌性的可能或對生殖力的影響。
於小白鼠體內微核分析(micronucleus test)或沙門氏菌-大腸桿菌(Ames)測試法中沒有觀察到adalimumab誘變(clastogenic)或致突變(mutagenic)影響。
懷孕
胚胎-胎兒產期發育毒性試驗已於cynomolgus猴執行,劑量最高達100 mg/kg (約為人類當每週皮下投與40mg且併用MTX時AUC的266倍或當每週皮下投與40mg但無MTX時AUC的373倍),顯示並無adalimumab對胎兒造成傷害的證據。然而,並未於懷孕婦女中執行適當且受到良好控制的試驗。由於動物生殖和發育試驗並不能完全預測人體反應,除非必要才可於懷孕時使用Humira。
尚未有adalimumab於懷孕婦女的臨床資料。因此,除非必要,不應於懷孕時使用Humira。
應建議育齡婦女於接受Humira治療期間避免懷孕。
生產和分娩
Humira對生產和分娩無已知影響。
哺乳母親
尚未知adalimumab是否會分泌於人類乳汁中或於進食後被系統性的吸收。
由於許多藥物和免疫球蛋白會經由乳汁分泌,並且因為Humira對哺乳中嬰兒有潛在的嚴重不良反應,應考慮藥物對母親的重要性以決定是否停止哺乳或停藥。
兒童的使用
尚未在小兒科的病患研究安全性和有效性。
老年人的使用
在Humira臨床試驗的所有受試者中,22%為65歲和65歲以上,而約有5%為75歲和75歲以上。這些受試者和較年輕的病患在安全性和有效性大致上並未觀察到有差別。雖然並沒有觀察到老年病患和年輕病患於反應上有差別,但並不能排除有些較年老的病患敏感度較高。
不良反應
Humira已在2334位病患進行安慰劑控制的臨床試驗和長期追蹤試驗,其中包括2073位病患接受治療6個月,1497位病患接受治療超過一年。表中資料是根據適當且受到良好控制的試驗一、二、三和四,包含1380位於安慰劑控制的階段隨機接受adalimumab治療的病患。這些病患的平均年齡為54.5歲,77%為女性,91%為白人,並患有中度至重度的類風濕性關節炎。大部分的病患每隔一週接受40 mg的Humira。
在試驗一、二、三和四中,於雙盲、安慰劑控制階段因不良事件而中斷治療的病患中,有6.6%為使用Humira的病患,而有4.2%為接受安慰劑的病患(見章節5.1)。接受Humira的病患整體中斷率為12.7%,而接受安慰劑的病患則為16.8%。Humira最常見的停藥原因是不良事件(6.6%)、缺乏療效(2.4%)和撤回試驗同意書 (1.9%)。
至少可能與adalimumab有因果關係的不良事件,包括臨床和實驗室檢驗,依系統器官分類和頻率(非常常見>1/10;常見>1/100≤1/10;不常見>1/1000 ≤1/100)列於表四。
|
表四 臨床試驗中的不良 |
||
|
腫瘤 |
不常見 |
皮膚良性腫瘤 |
|
血液和淋巴系統 |
常見 |
血紅素降低 |
|
不常見 |
顆粒性白血球過少症、凝血時間增加、抗核抗體出現、白血球減少、淋巴
|
|
|
代謝和營養異常 |
常見 |
高血脂症 |
|
不常見 |
高膽固醇血症、鹼性磷酸酶增加、BUN增加、高尿酸血症、周邊性水腫、體重增加、血清肌氨
|
|
|
精神障礙 |
不常見 |
憂鬱、思睡、失眠、焦慮 |
|
神經系統 |
常見 |
頭疼、頭暈 |
|
不常見 |
感覺異常、暈眩、知覺遲鈍、神經痛、顫抖
|
|
|
特別感官 |
不常見 |
結膜炎、眼疾、中耳炎、味覺倒錯、視力異常、視力模糊、眼乾、耳疾、眼痛
|
|
心臟血管系統 |
不常見 |
高血壓、血管擴張、胸痛、偏頭痛 |
|
出血 |
不常見 |
瘀斑 |
|
呼吸系統 |
常見 |
上呼吸道感染、鼻炎、鼻竇炎、支氣管炎、咳嗽增加、肺炎
|
|
不常見 |
咽頭炎、呼吸困難、肺部疾病、氣喘 |
|
|
消化系統 |
常見 |
噁心、腹瀉、喉嚨痛 |
|
不常見 |
肝功能指數異常、SGPT值增加、SGOT值增加、口腔潰瘍、食道炎、嘔吐、消化不良、便秘、腸胃疼痛、牙病、胃炎、腸胃炎、舌頭疾病、口腔念珠菌感染、口瘡、吞嚥困難、口腔炎、潰瘍性口腔炎
|
|
|
皮膚和附屬部位 |
常見 |
紅疹、搔癢、單純庖疹 |
|
不常見 |
皮膚病、帶狀庖疹、斑狀丘疹、指甲異常、皮膚乾燥、出汗增加、脫髮、黴菌皮膚炎、蕁麻疹、皮膚結節、皮膚潰瘍、濕疹、皮下血腫
|
|
|
肌肉骨骼系統 |
不常見 |
關節痛、肌肉痙攣、肌痛、關節異常、滑膜炎、肌腱異常 |
|
泌尿生殖系統 |
常見 |
泌尿道感染 |
|
不常見 |
陰道念珠菌感染、血尿、膀胱炎、經血過多、蛋白尿、頻尿
|
|
|
全身性 |
常見 |
實驗室試驗異常、衰弱、臨床瞑眩反應、感冒症狀、腹部疼痛、感染 |
|
不常見 |
發燒、黏膜異常
|
|
|
注射部位反應 |
非常常見 |
注射部位疼痛 |
|
|
注射部位反應、注射部位出血、注射部位出疹 |
|
|
一般過敏反應 |
不常見 |
過敏反應 |
注射部位反應
在安慰劑控制的試驗中,20%接受Humira治療的病患顯現注射部位反應(紅疹和/或發癢、出血、疼痛或腫脹),而只有14%接受安慰劑治療的病患顯現這些反應。大部分注射部位反應輕微且大多不需停藥。
感染
在安慰劑控制的試驗中,Humira治療的病患感染率為1個/人年,而安慰劑治療的病患為0.9個/人年。以Humira治療的病患嚴重感染的發生率為0.04個/人年,而安慰劑治療的病患為0.02個/人年。這些感染主要為上呼吸道感染、支氣管炎和尿道感染。大部分的病患在感染去除後繼續接受Humira的治療。
惡性腫瘤
在2334位於臨床試驗中接受Humira的治療最長達53個月的類風濕性關節炎病患中,觀察到有24位非黑色素瘤皮膚癌和30位其他不同腫瘤。沒有足夠資料確定Humira是否會促成這些腫瘤的發展。觀察到的發生率和發病率與群體研究的預期相似。
自體抗體
對病患在多個時間點的血清樣本測試自體抗體。在適當且受到良好控制的試驗中,於基準點呈現陰性抗核抗體效價的病患,有12.6%接受Humira治療的病患和7.3%接受安慰劑治療的病患,於24週時呈現陽性效價。2334位接受Humira的病患中,有一位病患產生顯示新發生的類紅斑性狼瘡之臨床症狀。該病患於停止治療後獲得改善。沒有病患顯現紅斑性狼瘡腎炎或中樞神經系統的症狀。尚不清楚長期以Humira治療對發展自體免疫疾病的影響。
過量
尚未確認Humira的人體最大耐受劑量。未曾於Humira的臨床試驗中發現劑量限制性毒性。曾在臨床試驗中對病患投與高達10 mg/kg的多次劑量,並無劑量限制性毒性的證據。如發生過量,建議觀察病患是否有任何不良反應的症狀或影響,並且立即給予適當的症狀性治療。
劑量和給藥
本藥限由醫師使用
成年類風濕性關節炎病患的Humira建議劑量為每隔一週皮下注射單一劑量40 mg。Methotrexate、糖質類固醇、水楊酸、非類固醇類抗發炎藥物、止痛劑或其他DMARDs藥物可於Humira治療期間繼續使用。
有些沒有併用MTX的病患,則可能從增加Humira的給藥頻率至每週40 mg得到好處(非必須)。
Humira的準備
Humira應於醫師的指導及監視下使用。如果醫師認定為適當的並且有醫療追蹤時,如有需要的話,於適當的注射技巧訓練後,病患可自行注射Humira。
自行注射的部位包括大腿或腹部。應輪換注射部位。絕不可於敏感、瘀青、紅或硬的皮膚給予新注射。
非經腸道的藥物若溶液和容器許可,應於注射前視察微粒和變色。
Humira不應於相同的注射器或藥瓶中與其他藥物混合。任何未用的產品或廢棄物應依當地規定處置。
儲存
儲存於2 ° C至8 ° C(36 ° F至46 ° F)(於冷藏室中)並儲存注射器或藥瓶於外盒包裝中。不要冷凍。
超過有效期限後請勿使用。
包裝
Humira (adalimumab)注射溶液為40 mg的adalimumab無菌溶液溶於0.8 mL的無菌溶液,以下列的非經腸道注射包裝型式供應:
含Humira 40 mg注射溶液的單次使用預充填式注射器(供病患使用)
● 紙盒中裝有1個內含1個預充填式注射器的鋁箔包和1個酒精棉片
● 紙盒中裝有2個鋁箔包,各內含1個預充填式注射器和1個酒精棉片
● 貨號3799
含Humira 40 mg注射溶液的單次使用附針頭防護裝置的預充填式注射器 (供醫院和醫護人員使用)
● 紙盒中裝有1個內含1個附針頭防護裝置的預充填式注射器之鋁箔包,和1個酒精棉片
● 貨號3799
含Humira 40 mg注射溶液的單次使用小瓶
● 紙盒中裝有1個內含1個小瓶的鋁箔包、一個袋裝的無菌空注射針筒和2個酒精棉片。小瓶附橡膠蓋、鋁箔折邊和拉蓋。
● 貨號3797
並非所有包裝大小皆會銷售
針筒裝注射劑
製造廠:Vetter Pharma-Fertigung GmbH & Co. KG for Abbott Laboratories
廠 址: Schutzenstrasse 87 D-88212 Ravensburg, Germany
注射劑
製造廠: Wasserburger Arneimittelwerk Dr. Madaus GmbH for Abbott Laboratories
廠 址: Herderstrasse 2, 83512, Wasserburg, Germany
包裝廠: Vetter Pharma-Fertigung GmbH & Co. KG
廠 址: Schutzenstrasse 87 D-88212 Ravensburg, Germany
藥 商:美商亞培股份有限公司台灣分公司
地 址:台北市民生東路三段51號6樓
電 話:(02)25050828